Toda la materia posee masa y volumen, sin embargo la masa de sustancias diferentes ocupan distintos volúmenes.

La propiedad que nos permite medir la ligereza o pesadez de una sustancia recibe el nombre de densidad. Cuanto mayor sea la densidad de un cuerpo, más pesado nos parecerá.

La densidad se define como el cuociente entre la masa de un cuerpo y el volumen que ocupa. Así, como en el Sistema Internacional , la masa se mide en kilogramos (kg) y el volumen en metros cúbicos (m3) la densidad se medirá en kilogramos por metro cúbico (kg/m3).
La mayoría de las sustancias tienen densidades similares a las del agua por lo que, de usar esta unidad, se estarían usando siempre números muy grandes. Para evitarlo, se suele emplear otra unidad de medida el gramo por centímetro cúbico (gr/cm3).
La densidad de un cuerpo está relacionada con su flotabilidad, una sustancia flotará sobre otra si su densidad es menor.

GASES
EL OBJETIVO ES :
*En este blog podremos observar todo lo relacionado con los gases, observando sus diversas formas, volúmenes y reacciones.
* Enseñar a los lectores a tener una experiencia mas profunda con los temas tratados en donde hayan dificultades.
TEMAS A TRATAR
1-conocer las formulas y los procesos para poder realizar ejercicios.
2-conocer las definiciones de los elementos de los temas a tratar.
3-practicar con aquellos ejercicios.
MARCO TEÓRICO
GASES:
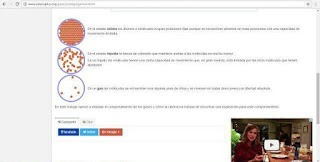
Se denomina gas al estado de agregación de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
ESTADOS DE AGREGACIÓN:
En física y química se observa que, para cualquier sustancia o mezcla, modificando sus condiciones de temperatura o presión, pueden obtenerse distintos estados o fases, denominados estados de agregación de la materia, en relación con las fuerzas de unión de las partículas (moléculas, átomos o iones) que la constituyen.
- Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
- Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
- Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
TEMPERATURA:

La Temperatura es una propiedad de la materia que está relacionada con la sensación de calor o frío que se siente en contacto con ella. Cuando tocamos un cuerpo que está a menos temperatura que el nuestro sentimos una sensación de frío, y al revés de calor. Sin embargo, aunque tengan una estrecha relación, no debemos confundir la temperatura con el calor.
Cuando dos cuerpos, que se encuentran a distinta temperatura, se ponen en contacto, se produce una transferencia de energía, en forma de calor, desde el cuerpo caliente al frío, esto ocurre hasta que las temperaturas de ambos cuerpos se igualan. En este sentido, la temperatura es un indicador de la dirección que toma la energía en su tránsito de unos cuerpos a otros.
*La medida:
El instrumento utilizado habitualmente para medir la temperatura es el termómetro. Los termómetros de líquido encerrado en vidrio son los más populares; se basan en la propiedad que tiene el mercurio, y otras sustancias (alcohol coloreado, etc.), de dilatarse cuando aumenta la temperatura. El líquido se aloja en una burbuja -bulbo- conectada a un capilar (tubo muy fino). Cuando la temperatura aumenta, el líquido se expande por el capilar, así, pequeñas variaciones de su volumen resultan claramente visibles.
*Escalas:
Actualmente se utilizan tres escalas para medir al temperatura, la escala Celsius es la que todos estamos acostumbrados a usar, la Fahrenheit se usa en los países anglosajones y la escala Kelvin de uso científico.
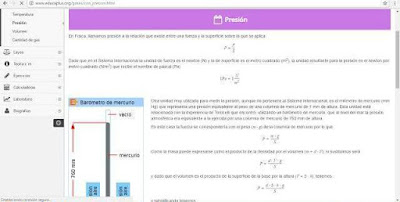
PRESIÓN:
La presión de un gas se origina por el choque de sus moléculas con las paredes del recipiente que lo contiene. Cuanto más moléculas choquen mayor será la presión y cuanto más rápido se muevan (que es lo mismo que estar a mayor temperatura), mayor será la presión.
A continuación puedes ver el comportamiento de dos gases. Observa que la presión sólo cambia si modificas la temperatura del gas (las moléculas se mueven más deprisa) o si aumentas el número de moléculas (se producen más choques). Si aumentas la masa de las moléculas, la presión no cambia, ya que las moléculas se mueven más lentamente.
Si haces que la presión no cambie (pulsando sobre el botón correspondiente) observarás el mismo efecto con el volumen: sólo cambia si aumentas el número de moléculas o su temperatura, si cambias la masa de las moléculas el volumen permanece constante.
Volumen:
El volumen es la medida del espacio que cupa un cuerpo. Su unidad de medida S.I. es el metro cúbico (m3), sin embargo, a menudo se usa el litro (L)
La temperatura influye sobre el volumen de los sólidos, líquidos y gases.
- Si esta aumenta, los sólidos y los líquidos se dilatan ligeramente.
- Si disminuye, los sólidos y líquidos se contrae.
En los gases, la influencia de la temperatura es muy importante, como ya se vio en el tema de propiedades de los gases.
Midiendo Volúmenes
Existen diferentes formas de medir volúmenes. Para medir el volumen de:
- un líquido, se deben utilizar instrumentos como: probeta, pipeta, matraz de aforo o vasos de precipitados
CANTIDAD DE GAS:
La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol. Con el siguiente simulador puedes calcular las masas molares de algunas sustancias puras como el hidrógeno, el metano, el cloro y el yodo.
LEY DE AVOGRADRO:
Volúmenes iguales de dos gases en las mismas condiciones de temperatura y presión poseen el mismo número de moléculas. Esa ley fue el origen del concepto de molécula está implícita en el concepto de volumen molar (CNTP), pues 22,4 litros de cualquier gas poseen 6,02 x 1023 moléculas
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constante. En 1811 Avogadro realiza los siguientes descubrimientos:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientementedel elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Por lo tanto: V1 / n1 = V2 / n2
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen
LEY DE BOYLE:
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión: PV=k\,
donde k\, es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P_1V_1=P_2V_2\,
Además se obtiene despejada que:
P_1=P_2V_2/V_1\,
V_1=P_2V_2/P_1\,
P_2=P_1V_1/V_2\,
V_2=P_1V_1/P_2\,
Donde:
P_1\,= Presión Inicial
P_2\,= Presión Final
V_1\,= Volumen Inicial
V_2\,= Volumen Final
Además se obtiene despejada que:
P_1=P_2V_2/V_1\,
V_1=P_2V_2/P_1\,
P_2=P_1V_1/V_2\,
V_2=P_1V_1/P_2\,
Donde:
P_1\,= Presión Inicial
P_2\,= Presión Final
V_1\,= Volumen Inicial
V_2\,= Volumen Final
LEY DE CHARLES
es una de las leyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.

LEY DE GAY-LUSSAC:
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante. La presión del gas es directamente proporcional a su temperatura: Si aumentamos la temperatura, aumentará la presión

LEY GENERALIZADA:
La Ley General de los Gases consiste en la unión de las siguientes leyes:
- Ley de Boyle: P1 · V1 = P2 · V2
- Ley de Gay-Lussac: P1 / T1 = P2 / T2
- Ley de Charles: V1 / T1 = V2 / T2
Todas ellas se condensan en la siguiente fórmula que es aplicable para una misma cantidad de gas:
P1 · V1 / T1 = P2 · V2 / T2
donde:
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en grados Kelvin)
-
LABORATORIO.
TERCER PERIODO
MARCO TEORICO:
*BALANCEO DE ECUACIONES:
Una reaccion quimica es la manifestacion de un cambio en la materia y la isla de un fenomeno quimico a su expresion grafica se le da el nombre de escuacion quimica en la cual se expresan en la primera parte los reactivos y en la segunda los productos de reaccion
A+BC+D
REACTIVOS PRODUCTIVOS
Para balancear ecuaciones quimicas, existen diversos metodos. En todos el objetivo que se persigue es que la ecuacion quimica cumpla la ley de la conservacion de la materia.
*BALANCEO DE ECUACIONES POR EL METODO DE TANTEO
Balanceo de ecuaciones por el método de Tanteo
El método de tanteo consiste en observar que cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en
Ejemplo: Balancear la siguiente ecuación
H2O + N2O5 NHO3
H2O + N2O5 2 NHO3
Otros ejemplos
HCl + Zn ZnCl2 H2
2HCl + Zn ZnCl2 H2
KClO3 KCl + O2
2 KClO3 2KCl + 3O2
* BALANCEO POR OXIDO REDUCCION
En una reacción si un elemento se oxida, también debe existir un elemento que se reduce. Recordar que una reacción de oxido reducción no es otra cosa que una perdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor, electricidad, etc.)
Para balancear una reacción por este método , se deben considerar los siguiente pasos
1)Determinar los números de oxidación de los diferentes compuestos que existen en la ecuación.
Para determinar los números de oxidación de una sustancia, se tendrá en cuenta lo siguiente:
0 0 +3 -2
Fe + O2 Fe2O3
Los elementos que cambian su numero de oxidación son el Fierro y el Oxigeno, ya que el Oxigeno pasa de 0 a -2 Y el Fierro de 0 a +3
3) se comparan los números de los elementos que variaron, en la escala de Oxido-reducción
0 0 +3 -2
Fe + O2 Fe2O3
El fierro oxida en 3 y el Oxigeno reduce en 2
4) Si el elemento que se oxida o se reduce tiene numero de oxidación 0 , se multiplican los números oxidados o reducidos por el subíndice del elemento que tenga numero de oxidación 0
Fierro se oxida en 3 x 1 = 3
Oxigeno se reduce en 2 x 2 = 4
5) Los números que resultaron se cruzan, es decir el numero del elemento que se oxido se pone al que se reduce y viceversa
4Fe + 3O2 2Fe2O3
Los números obtenidos finalmente se ponen como coeficientes en el miembro de la ecuación que tenga mas términos y de ahí se continua balanceando la ecuación por el método de tanteo
Otros ejemplos
KClO3 KCl + O2
+1 +5 -2 +1 -1 0
KClO3 KCl + O2
Cl reduce en 6 x 1 = 6
O Oxida en 2 x 1 = 2
2KClO3 2KCl + 6O2
Cu + HNO3 NO2 + H2O + Cu(NO3)2
0 +1 +5 -2 +4 -2 +2 -2 +2 +5 -2
Cu + HNO3 NO2 + H2O + Cu(NO3)2
Cu oxida en 2 x 1 = 2
N reduce en 1 x 1 = 1
Cu + HNO3 2NO2 + H2O + Cu(NO3)2
Cu + 4HNO3 2NO2 + 2H2O + Cu(NO3)2
EJERCICIO ELABORADO EN CLASE
NIVELACION 3 PERIODO
VIDEO
https://www.youtube.com/watch?v=Pl2NZQkSl-0
MODULO
http://es.slideshare.net/lauradanielaespinosa1/mdulo-de-aprendizaje-66615667













































No hay comentarios:
Publicar un comentario